Клиническая оценка оптоэлектронного устройства при скрининге рака шейки матки в реальном времени
Авторы:
Yingting Wei, Wenjing Wang, Mengxing Cheng, Zubei Hong, Liying Gu, Jiaxin Niu, Wen Di, Lihua Qiu
Цель: Ранний скрининг и вмешательство имеют решающее значение для профилактики и лечения рака шейки матки. TruScreen - это интеллектуальная технология диагностики патологии в режиме реального времени, предназначенная для скрининга рака шейки матки. Целью данного исследования было оценить клиническую ценность TruScreen для скрининга заболеваний шейки матки.
Дизайн исследования: В исследовании приняли участие 458 женщин в возрасте от 25 до 65 лет. Пациентки были отобраны для прохождения скрининга рака шейки матки, включающего тестирование на вирус папилломы человека (ВПЧ), цитологическое исследование с использованием цитологического теста ThinPrep (TCT) и TruScreen с декабря 2018 по январь 2020 года. Клиническая эффективность TruScreen, отдельно и в сочетании с тестированием на ВПЧ, оценивалась с точки зрения выявления цервикальной интраэпителиальной неоплазии 2-й степени или выше (CIN2+ или CIN3+).
Результаты: Для выявления CIN2+ чувствительность и специфичность TruScreen составили 83,78% и 78,86%, соответственно. Специфичность TruScreen была значительно выше, чем у ВПЧ-тестирования (50,59%, P < 0,001) и ТСТ (55,58%, P < 0,001). У ВПЧ-позитивных женщин высокого риска специфичность ВПЧ-тестирования в сочетании с TruScreen была значительно выше, чем при ВПЧ-тестировании в сочетании с ТСТ (50% против 39,9%, P = 0,004). Чувствительность тестирования на ВПЧ в сочетании с TruScreen была сопоставима с чувствительностью тестирования на ВПЧ в сочетании с TCT (93,94% против 87,88%, P = 0,625). Аналогичная картина наблюдалась и для случаев CIN3+.
Выводы: TruScreen обладает потенциалом для скрининга предраковых поражений шейки матки высокой степени и может заменить цитологические тесты в качестве метода скрининга рака шейки матки в Китае, при отсутствии субъективности в интерпретации цитологических тестов и требований к профессионализму патоморфологов.
Сокращения: ASCUS - атипичные плоские клетки неопределенного значения; CIN - цервикальная интраэпителиальная неоплазия; CIN2+ - CIN 2 степени или выше; CIN3+ - CIN 3 степени или выше; HPV - вирус папилломы человека; HR-HPV - HPV высокого риска; HSIL - плоскоклеточное интраэпителиальное поражение высокой степени; LSIL - плоскоклеточное интраэпителиальное поражение низкой степени; NILM - негативное интраэпителиальное поражение или злокачественная опухоль; NPV - отрицательное прогностическое значение; PPV - положительное прогностическое значение; TCT - цитологический тест ThinPrep.
Введение
Рак шейки матки - одна из самых распространенных злокачественных опухолей, занимающая четвертое место по заболеваемости и смертности среди женщин во всем мире. В 2018 году было зарегистрировано около 570 000 случаев рака шейки матки и 311 000 смертей от него [1]. Из-за отсутствия всеобщего доступа к вакцинам и скринингу на долю Китая приходится около 18,6 % глобального бремени рака шейки матки: 106 000 случаев рака шейки матки и 48 000 смертей от рака шейки матки в год [2]. С тех пор как Харальд цур Хаузен впервые описал связь между вирусом папилломы человека (ВПЧ) и раком шейки матки [3], сегодня широко известно, что персистирующая инфекция ВПЧ высокого риска (HR-HPV) тесно связана с возникновением рака шейки матки [4]. Прогрессирование HR-HPV-инфекции до предраковых поражений шейки матки и возникновения инвазивного рака шейки матки - это динамический процесс, который занимает 5-15 лет. Поэтому эффективный ранний скрининг и вмешательство чрезвычайно важны для снижения заболеваемости и смертности, связанных с раком шейки матки. В настоящее время широко используемые методы скрининга рака шейки матки включают анализ ДНК ВПЧ и цитологическое исследование [5]. Однако скрининг рака шейки матки смещается от первичного цитологического тестирования к первичному тестированию на ВПЧ [6]. С развитием науки и техники оптоэлектронный прибор TruScreen привлек внимание международной общественности как новый вспомогательный метод скрининга рака шейки матки с использованием искусственного интеллекта, который обладает такими преимуществами, как получение результатов в режиме реального времени, прост в эксплуатации и объективен в результатах исследования [7]. Несмотря на то, что TruScreen используется в клинической практике в течение последних нескольких лет, в Китае имеется мало сообщений о диагностической эффективности этого прибора для выявления цервикальной интраэпителиальной неоплазии (CIN), особенно CIN степени 2 или выше (CIN2+).
Целью нашего исследования было оценить клиническую ценность TruScreen для скрининга рака шейки матки путем сравнения диагностических характеристик TruScreen, цитологического исследования и тестирования на ВПЧ для выявления случаев CIN2+ и CIN3+ и выше (CIN3+), и, в частности, сравнения этих двух методов у HR-HPV-позитивных китайских женщин.
Материалы и методы
В исследование были включены женщины в возрасте 25-65 лет, прошедшие оппортунистический скрининг на рак шейки матки с декабря 2018 по январь 2020 года в больнице Renji (филиал медицинской школы Шанхайского университета Цзяо Тун). Всем женщинам были проведены цитологический тест ThinPrep (TCT) и генотипирование ВПЧ. На основании результатов ТСТ и генотипирования ВПЧ пациентки были разделены на четыре группы, которые были подвергнуты стратифицированной выборке, в результате чего было 458 пациенток разделили на четыре группы следующим образом: (1) 94 случая с атипичными плоскими клетками неопределенного значения (ASCUS) или выше и HR-HPV-отрицательные случаи; (2) 120 случаев с TCT ASCUS или выше и HR-HPV-положительные случаи; (3) 123 TCT-отрицательных и HR-HPV-отрицательных случая; (4) 121 TCT-отрицательный и HR-HPV-положительный случай. Критерии исключения из стратифицированной выборки включали активные дни менструации в период обследования, гистерэктомию или трахелэктомию в анамнезе, беременность или послеродовой период <42 дней, предшествующую лучевую терапию или химиотерапию органов малого таза, неспособность принять участие в обследовании по каким-либо причинам, например, тяжелые хирургические или ортопедические заболевания, а также психические расстройства.
Всем испытуемым проводилось дополнительное обследование шейки матки с помощью оптоэлектронного сканера TruScreen в режиме реального времени. При получении аномальных результатов TruScreen, помимо генотипирования ВПЧ или ТСТ и электронной кольпоскопии, проводилась биопсия ткани шейки матки. Патоморфологический результат биопсии получали через неделю после кольпоскопического исследования. Весь цикл обследования были завершены в течение 2-4 недель.
TruScreen скрининг
Прибор TruScreen был поставлен компанией TruScreen Pty Ltd (Сидней, Австралия). Оператор использовал одноразовый фотоэлектрический сенсор, которым обследовал не менее чем 15 точек на поверхности шейки матки, как указанно в инструкции к прибору. Результаты получали в режиме реального времени. Результаты определялись как: (1) нормальный (аномальных клеток не обнаружено) или (2) аномальный (обнаружены патологические аномальные клетки).
ТСТ-скрининг (цитологический скрининг)
Образцы подвергались ТСТ в патологоанатомической лаборатории, и результаты рассматривались двумя патологоанатомами перед представлением отчета. Результаты анализировались по системе Бетесда и классифицировались как отрицательное внутриэпителиальное поражение (NILM) или наличие патологии ASCUS, HSIL - плоскоклеточное интраэпителиальное поражение высокой степени; LSIL - плоскоклеточное интраэпителиальное поражение низкой степени;, атипичные плоские клетки - нельзя исключить HSIL, плоскоклеточная карцинома, атипичные железистые клетки или аденокарцинома in situ.
Анализ на ВПЧ
Жидкие образцы, собранные врачом, были протестированы с помощью набора 21 HPV GenoArray Diagnostic Kit (Hybribio Ltd, Гонконг) в соответствии с инструкциями производителя, а 21 выявленный подтип включал 15 типов высокого риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66 и 68) и 6 типов низкого риска (6, 11, 42, 43, 44 и CP8304).
Электронная кольпоскопия и биопсия шейки матки
Шейку матки осматривали с помощью уксуснокислого и йодного тестов последовательно и наблюдали под микроскопом с увеличением. Биопсия подозрительных образований бралась для патоморфологического исследования. Кроме того, эндоцервикальный кюретаж проводился тем, у кого не удавалось полностью обнажить плоско-цилиндрический переход шейки матки. Патологические срезы просматривались двумя опытными патоморфологами перед представлением отчета. Результаты гистологического исследования были распределены как норма, измененная кондиломы, CIN 1- 3, карцинома in situ или инвазивный рак. Конечными точками были выбраны CIN2+ и CIN3+.
Комбинированный метод скрининга
Для дальнейшей проверки возможностей TruScreen выявить CIN2+ и CIN3+ по сравнению с цитологическим тестом среди 458 участниц была отобрана 241 женщина с HR-HPV-инфекцией. Показание к направлению на кольпоскопию считалось положительным критерием для комбинированных методов скрининга. Когда генотипирование ВПЧ в сочетании с TCT или TruScreen проводилось у HR-HPV-позитивных женщин, показаниями к кольпоскопии были HPV16/18-позитивные с TCT NILM или TruScreen нормальными результатами или HR-HPV-позитивные с TCT ASCUS-позитивными или TruScreen аномальными результатами.
Статистический анализ
Для обработки вышеуказанных данных использовалась программа IBM SPSS (версия 23.0). Чувствительность, специфичность, положительная прогностическая ценность (PPV) и отрицательная прогностическая ценность (NPV) каждого метода скрининга были рассчитаны с использованием CIN2+ и CIN3+ в качестве золотого стандарта. Для сравнения различий между группами использовался точный тест МакНемара v2. Статистическая значимость признавалась как P < 0,05.
Этические вопросы
Данное исследование проводилось в соответствии с принципами, изложенными в Хельсинкской декларации 1964 года и всех последующих редакциях. Оно было одобрено Комитетом по этике больницы Ренджи (филиал Медицинской школы Шанхайского университета Цзяо Тун) (референс-номер комитета: 2018-211). От всех участников, включенных в исследование, было получено информированное согласие.
Результаты
Исходные характеристики
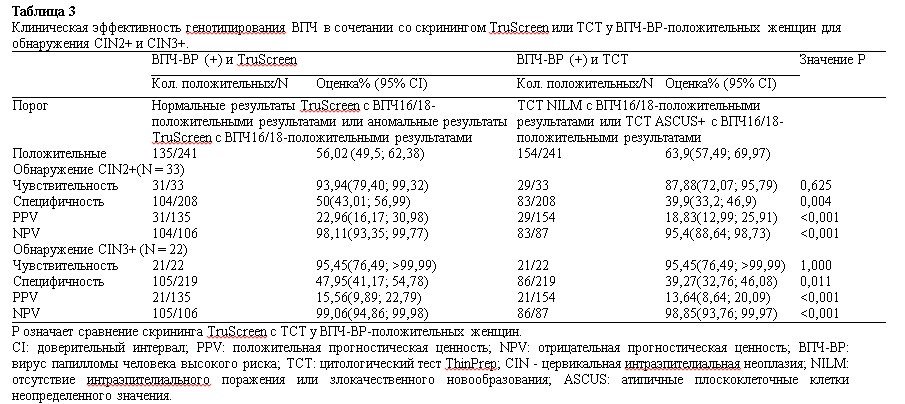
В исследование было включено 458 человек, средний возраст которых составил 41,52 года. Результаты патоморфологического исследования показали, что было 37 (8,08%) случаев CIN2+, включая 11 (2,40%), 24 (5,24%) и 2 (0,44%) случая CIN2, CIN3 и рака шейки матки, соответственно. Среди 458 обследованных было 69 (15,07%), 214 (46,72%) и 120 (26,20%) ВПЧ16/18-позитивных, TCT ASCUS или выше случаев и аномальный результат TruScreen, соответственно (табл. 1).
Результаты скрининга TruScreen
Положительный результат скрининга TruScreen заметно повышался по мере увеличения тяжести диагноза ТСТ: с 14,34% (35/244) у женщин с NILM до 100% (8/8) у женщин с HSIL. Аналогичным образом этот показатель увеличился с 25,68% (66/257) до 83,33% (20/24) и 100% (2/2) у женщин с нормальными результатами гистологии, CIN3 и раком шейки матки, соответственно (табл. S1). Диагностическая эффективность TruScreen в выявлении CIN2+ и CIN3+ Для выявления CIN2+ специфичность TruScreen (78,86%) была значительно выше, чем у ВПЧ-теста (50,59%, P < 0,001) и ТСТ (55,58%, P < 0,001).Кроме того, чувствительность TruScreen составила 83,78%, что было аналогично чувствительности ВПЧ-тестирования (89,19%, P = 0,754) и ТСТ (72,97%, P = 0,344). PPV TruScreen (25,83%) была значительно выше, чем у ВПЧ-тестирования (13,69%, P < 0,01) и ТСТ (12,62%, P < 0,01), а NPV (98,22%) была аналогична таковой у ВПЧ-тестирования (98,16%, P = 1,000) и ТСТ (95,90%, P = 0,091) (табл. 2). Аналогичные результаты были получены для случаев CIN3+. При сравнении с ВПЧ-тестированием и ТСТ TruScreen показал более высокую специфичность (77,31%) и PPV (18,33%), но аналогичную чувствительность (84,62%) и NPV (98,82%) (табл. 2).
Диагностическая эффективность комбинации ВПЧ-тестирования и TruScreen для выявления CIN2+ и CIN3+
В объединенных скрининговых исследованиях 241 HR-HPV-позитивной женщины 154 (63,90%) и 135 (56,02%) пациенток, прошедших скрининг с помощью генотипирования ВПЧ и ТСТ или генотипирования ВПЧ и TruScreen, соответственно, отвечали всем критериям для направления на кольпоскопию (табл. 3). Женщины с HR-HPV-положительными результатами были дополнительно направлены на TruScreen или TCT. У HR-HPV-положительных женщин с дальнейшей сортировкой с помощью TruScreen был более низкий процент положительных результатов (56,02%), но более высокая специфичность и аналогичная чувствительность, чем в группе, обследованной в рамках текущей стратегии скрининга рака шейки матки на основе сортировки TCT для первичного скрининга на ВПЧ (табл. 3). При выявлении CIN2+ с помощью TruScreen у HR-HPV-позитивных женщин специфичность (50% против 39,9%, P = 0,004), PPV (22,96% против 18,83%, P < 0,001) и NPV (98,11% против 95,4%, P < 0,001) были выше, чем у HR-HPV-позитивных женщин, прошедших скрининг с помощью ТСТ, а чувствительность двух методов скрининга была одинаковой (93,94% против 87,88%, P = 0,625) (Таблица 3).Для выявления CIN3+ чувствительность была одинаковой для обеих стратегий (95,45%), в то время как HR-HPV-позитивные женщины, прошедшие скрининг TruScreen, продемонстрировали значительно более высокую специфичность (47,95% против 39,27%, P = 0,011), PPV (15,56% против 13,64%, P < 0,001) и NPV (99,06% против 98,85%, P < 0,001), чем HR-HPV-позитивные женщины, прошедшие скрининг TCT (Таблица 3).
Обсуждение
Ранний скрининг и вмешательство являются ключевыми факторами профилактики и лечения рака шейки матки. Широкомасштабный и эффективный скрининг рака шейки матки и применение вакцины против ВПЧ позволили значительно снизить заболеваемость раком шейки матки во многих странах [8]. Однако в большинстве развивающихся стран показатели заболеваемости раком шейки матки остаются высокими [9], что может быть связано с отсутствием экономического потенциала, ограниченным медицинским обслуживанием, неадекватным скринингом рака и отсутствием всеобщего доступа к вакцинам. В Китае, несмотря на значительную заболеваемость и смертность от ВПЧ-ассоциированного рака шейки матки, уровень вакцинации и охвата скринингом остается низким. В настоящее время уровень скрининга рака шейки матки среди китайских женщин составляет 21,4 % [10]. Вакцина против ВПЧ стоит дорого и доступна лишь в ограниченном количестве, несмотря на то, что в последние годы она импортируется в Китай [11]. Из-за этих факторов большинство китайских женщин до сих пор не вакцинированы.
Цитологические методы выявления широко используются в клинической практике, однако получение результатов часто занимает несколько дней из-за задержек, связанных с транспортировкой образцов в лаборатории для анализа и составления отчета. Кроме того, на результаты цитологического исследования легко влияют субъективные факторы, такие как отбор образцов и различный опыт интерпритации результатов патологии, что приводит к низкой чувствительности и высокой частоте пропущенных диагнозов [12]. В одном из исследований [13] чувствительность жидкостных цитологических исследований составила 52%-94% и 52%-98% для выявления CIN2+ и CIN3+, соответственно. Кроме того, специфичность для выявления CIN2+ находилась в диапазоне 73%-97%. ВПЧ-тестирование более чувствительно, чем цитологические методы, для выявления интраэпителиальной неоплазии шейки матки высокой степени [14]. Примечательно, что большинство ВПЧ-инфекций протекает транзиторно, что приводит к высокой частоте ложноположительных результатов ВПЧ-тестирования. Число лиц, направленных на кольпоскопию из-за положительных результатов теста на ВПЧ, в два раза превышает число лиц, направленных на цитологию [15]. Это приводит к ненужному тестированию и лечению в связи с гипердиагностикой и увеличивает физическую, психологическую и экономическую нагрузку на пациентов. Поэтому крайне важно найти эффективный адекватный метод скрининга для повышения точности диагностики предраковых поражений шейки матки.
TruScreen - это оптоэлектронная интеллектуальная технология скрининга рака шейки матки и предраковых состояний в режиме реального времени. Эта технология представляет собой объективную самотестирующуюся цифровую систему, которую может использовать медицинский врачебный или средний медицинский персонал с минимальной подготовкой и без затрат на инфраструктуру и ресурсы, связанные со скринингом на основе цитологии. TruScreen использовался в качестве дополнения к инструментам скрининга рака шейки матки в клинических исследованиях [16]. Абдул и др. [17] обнаружили, что чувствительность и специфичность TruScreen при выявлении CIN2/3 составили 74% и 53 % соответственно. В другом многоцентровом исследовании чувствительность TruScreen для выявления CIN2/3 составила 70 % [18]. В нашем исследовании результаты чувствительности и специфичности, представленные в таблице 2, свидетельствуют о том, что TruScreen хорошо работает в качестве инструмента первичного скрининга для выявления CIN2+ и CIN3+.
В нашем исследовании мы также оценили клиническую эффективность TruScreen для выявления CIN2+ и CIN3+ у HR-HPV-позитивных женщин и сравнили ее с эффективностью TCT. Для выявления CIN2+ TruScreen показал более высокую специфичность, PPV и NPV, чем TCT, в то время как чувствительность обоих методов была сходной. Аналогичная картина наблюдалась и при выявлении CIN3+.
О диагностической ценности TruScreen при первичном ВПЧ-скрининге на рак шейки матки сообщалось редко. В исследовании Pruski et al. [19], где порогом для тестирования на ВПЧ в сочетании с опто-электронным методом было отклонение либо HR-HPV, либо опто-электронного метода, что отличалось от результатов нашего исследования, чувствительность тестирования на ВПЧ в сочетании с оптоэлектронным методом для выявления CIN2/3 составила 100 %. В другом недавнем исследовании, где пороговое значение ВПЧ-тестирования в сочетании с TruScreen было таким же, как и в нашем исследовании, чувствительность и специфичность для выявления женщин с CIN2+ составили 96,3 % и 36,8 % соответственно [20]. Эти результаты позволили предположить, что ценность выявления HR-HPV-позитивных образцов при дальнейшей сортировке с помощью TruScreen не хуже, чем при текущей стратегии скрининга рака шейки матки, основанной на TCT-сортировке первичного скрининга на ВПЧ при раке шейки матки.
Однако TruScreen не может определять степень патологии шейки матки, как это делается при ТСТ. Хотя TruScreen стоит столько же, сколько анализ на ВПЧ, и немного дороже, чем ТРУЗИ, в некоторых частях Китая, например в провинциях Цзянсу, Шаньдун и Хэбэй, TruScreen покрывается медицинской страховкой. По мере того как все больше медицинских учреждений будут внедрять TruScreen и все больше людей будут использовать его для скрининга рака шейки матки, мы считаем, что эта технология вскоре будет включена в систему здравоохранения в других частях Китая. Кроме того, преимуществами TruScreen являются получение результатов в режиме реального времени, объективность, не инвазивность, портативность и простой метод работы, не требующий высокой квалификации оператора. Чтобы выбрать разумный метод скрининга рака шейки матки, важно учитывать не только показатели скрининга (такие как чувствительность и специфичность), но и применимость метода (включая стоимость, эффективность и приверженность пациентов) [21]. Приверженность пациентов улучшается, поскольку TruScreen более приемлем для женщин, чем цитологический тест, так как во время исследования не нужно брать ткань шейки матки, что означает минимальный или нулевой дискомфорт. Кроме того, результаты предоставляются в режиме реального времени, поэтому вместо того, чтобы ждать результатов теста и записываться на повторный прием, пациентки могут сразу спросить у врача, нужно ли им дальнейшее лечение. В определенной степени это позволяет избежать беспокойства, которое может возникнуть в ожидании заключения.
Наше исследование имеет ряд ограничений. У нас было ограниченное количество испытуемых, поэтому необходимы будущие исследования для подтверждения клинической ценности TruScreen в качестве скринингового инструмента для рака шейки матки в более широкой популяции. Кроме того, TruScreen не проводился одновременно с ВПЧ-тестированием и ТСТ, что могло привести к необъективности наблюдений.
Заключение
В заключение следует отметить, что в нашем исследовании оценивалась клиническая ценность TruScreen для выявления CIN2+ и CIN3+ как самостоятельно, так и в качестве сортировки у HR-HPV-положительных женщин. Результаты показывают, что прибор TruScreen имеет потенциал для использования в качестве скринингового инструмента для выявления рака шейки матки. Это дает дополнительную возможность применения соответствующих методов скрининга рака шейки матки в Китае.
Заявление об авторском вкладе
Yingting Wei:,Wenjing Wang:,Mengxing Cheng:,Zubei Hong:, Liying Gu:,Jiaxin Niu:,Wen Di:,Lihua Qiu:.
Декларация о конкурирующих интересах
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, представленную в данной статье.
Благодарности
Не применимо.
Доступность данных и материалов
Все данные, полученные или проанализированные в ходе данного исследования, включены в настоящую опубликованную статью и дополнительные информационные файлы к ней.
Согласие на публикацию
Не применимо.
Финансирование
Работа выполнена при финансовой поддержке Научно-технической комиссии муниципалитета Шанхая (№ 18411963100 и 18441904800), Национальной ключевой программы исследований и разработок (863) Китая (№ 2016YFC1302900), Национального фонда естественных наук Китая (№ 81772770 и 81874101), Шанхайской муниципальной комиссии здравоохранения и планирования семьи (№ 2017ZZ02016 и ZY[2018-2020]-FWTX3006), Шанхайской муниципальной ключевой клинической специальности и программы Центра развития Шанхайской больницы (№ 16CR2001A).
Вклад авторов
WD и LQ разработали проект и руководили им. WW, ZH, LG, MC и JN собрали клинические образцы. YW и WW собрали и обработали данные. YW выполнил анализ данных. YW и WW подготовили рукопись. Все авторы просмотрели, обсудили и отредактировали окончательный вариант рукописи. YW и WW являются соавторами и внесли равный вклад в подготовку данной статьи.
Приложение A. Дополнительные данные Дополнительные данные к этой статье можно найти в Интернете на сайте https://doi.org/10.1016/j.ejogrb.2021.09.027.
Ссылки
[1] Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018;68:394–424.
[2] Arbyn M, Weiderpass E, Bruni L, de Sanjosé S, Saraiya M, Ferlay J, et al. Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. Lancet Glob Health 2020;8(2):e191–203.
[3] zur Hausen H. Papillomaviruses and cancer: from basic studies to clinical application. Nature reviews. Cancer 2002;2(5):342–50.
[4] Roden RBS, Stern PL. Opportunities and challenges for human papillomavirus vaccination in cancer. Nat Rev Cancer 2018;18(4):240–54.
[5] Gynecologists TACooa. Cervical Cancer Screening and Prevention. Obstet Gynecol. 2016; 127: 1-20.
[6] Wentzensen N, Arbyn M, Berkhof J, Bower M, Canfell K, Einstein M, et al. Eurogin 2016 Roadmap: how HPV knowledge is changing screening practice. Int J Cancer 2017;140(10):2192–200.
[7] Salazar-Campos JE, Gonzalez-Enciso A, Diaz-Molina R, Lara-Hernandez ME, Coronel-Martinez J, Perez-Plasencia C, et al. Cervicouterine cancer screening - TruScreen (TM) vs. conventional cytology: pilot study. J Cytol 2018;35:143–8.
[8] Curry SJ, Krist AH, Owens DK, Barry MJ, Caughey AB, Davidson KW, et al. Screening for cervical cancer: US preventive services task force recommendation statement. JAMA 2018;320(7):674. https://doi.org/ 10.1001/jama.2018.10897.
[9] Vu M, Yu J, Awolude OA, Chuang L. Cervical cancer worldwide. Curr Probl Cancer 2018;42(5):457–65.
[10] Bao H, Zhang L, Wang L, Zhang M, Zhao Z, Fang L, et al. Significant variations in the cervical cancer screening rate in China by individual-level and geographical measures of socioeconomic status: a multilevel model analysis of a nationally representative survey dataset. Cancer Med 2018;7 (5):2089–100.
[11] Zou Z, Fairley CK, Ong JJ, Hocking J, Canfell K, Ma X, et al. Domestic HPV vaccine price and economic returns for cervical cancer prevention in China: a costeffectiveness analysis. Lancet Glob Health 2020;8(10):e1335–44.
[12] Wright TC, Stoler MH, Behrens CM, Sharma A, Sharma K, Apple R. Interlaboratory variation in the performance of liquid-based cytology: insights from the ATHENA trial. Int J Cancer 2014;134(8):1835–43.
[13] Koliopoulos G, Nyaga VN, Santesso N, Bryant A, Martin-Hirsch PP, Mustafa RA, et al. Cytology versus HPV testing for cervical cancer screening in the general population. Cochrane Database Syst Rev 2017;8. CD008587.
[14] Rijkaart DC, Berkhof J, Rozendaal L, van Kemenade FJ, Bulkmans NWJ, Heideman DaniëlleAM, et al. Human papillomavirus testing for the detection of high-grade cervical intraepithelial neoplasia and cancer: final results of the POBASCAM randomised controlled trial. Lancet Oncol 2012;13(1):78–88.
[15] Wright TC, Stoler MH, Behrens CM, Sharma A, Zhang G, Wright TL. Primary cervical cancer screening with human papillomavirus: end of study results from the ATHENA study using HPV as the first-line screening test. Gynecol Oncol 2015;136(2):189–97.
[16] Long S, Lei W, Feng Y, Lv D, Cai Y, Yang P. The feasibilities of TruScreen for primary cervical cancer screening: a self-controlled study. Arch Gynecol Obstet 2013;288(1):113–8.
[17] Abdul S, Brown BH, Milnes P, Tidy JA. The use of electrical impedance spectroscopy in the detection of cervical intraepithelial neoplasia. Int J Gynecol Cancer 2006;16:1823–32.
[18] Singer A, Coppleson M, Canfell K, Skladnev V, Mackellar G, Pisal N, et al. A real time optoelectronic device as an adjunct to the Pap smear for cervical screening: a multicenter evaluation. Int J Gynecol Cancer 2003;13(6):804–11.
[19] Pruski D, Kedzia W, Przybylski M, Józefiak A, Purol M, Spaczyn´ ski M. Assessment of optoelectronic method and molecular test usefulness for cervical intraepithelial neoplasia and cervical cancer detection. Ginekol Pol 2010;81:426–30.
[20] Wang Z, Kang Y, Yu F, Zhong F-H, Huang K, Zhou X, et al. TruScreen detection of cervical tissues for high-risk human papillomavirus-infected women during the COVID-19 pandemic. Future Oncol 2021;17(10):1197–207.
[21] Sawaya GF, Sanstead E, Alarid-Escudero F, Smith-McCune K, Gregorich SE, Silverberg MJ, et al. Estimated Quality of life and economic outcomes associated with 12 cervical cancer screening strategies: A cost-effectiveness analysis. JAMA Intern Med 2019;179(7):867. https://doi.org/ 10.1001/jamainternmed.2019.0299.
Таблица 1.
Распределение HR-HPV, TCT и TruScreen по результатам гистологического исследования среди 458 женщин.
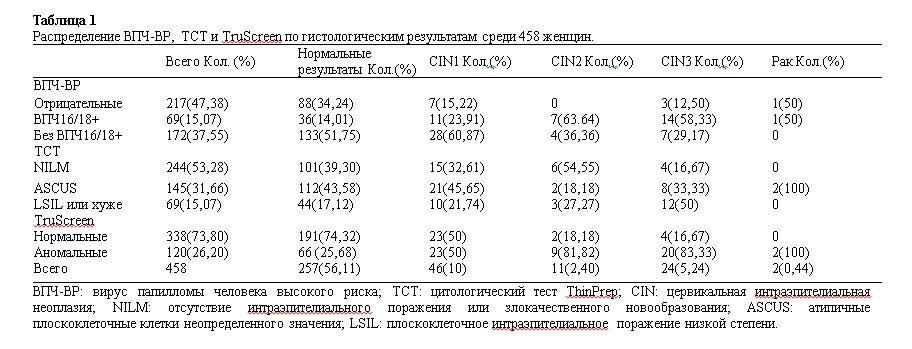
Таблица 2.
Клиническая эффективность ВПЧ-тестирования, TCT и TruScreen для выявления CIN2+ и CIN3+
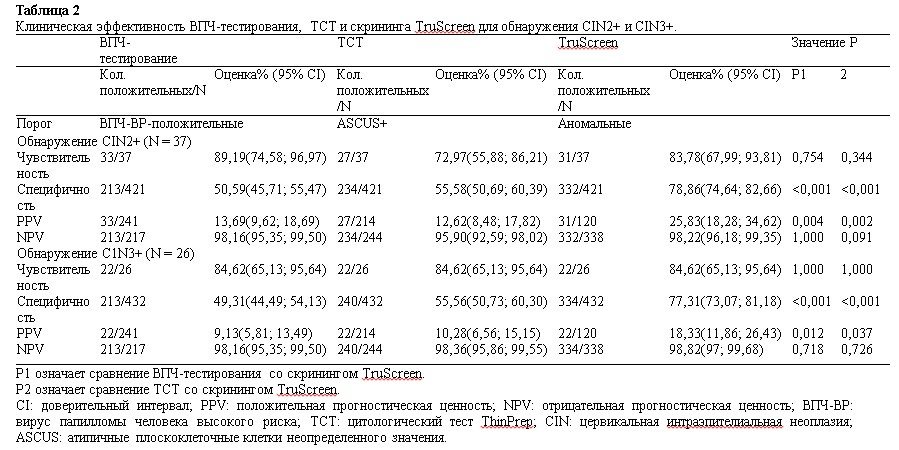
Таблица 3
Клиническая эффективность генотипирования ВПЧ в сочетании с TruScreen или TCT у HR-HPV-позитивных женщин для выявления CIN2+ и CIN3+