Оценка эффективности оптоэлектронного устройства для скрининга шейки матки в сравнении с цитологией и тестированием на ДНК ВПЧ
Аннотация
Цель: Оценка оптоэлектронного устройства скрининга (OESD) для выявления очагов цервикальной интраэпителиальной неоплазии (CIN) 2+ по сравнению с жидкостной цитологией (LBC) и тестированием на ДНК ВПЧ высокого риска (врВПЧ).
Методы: Всего 506 женщин, получивших направление на скрининг в связи с аномальной цитологией шейки матки или положительным тестом на ВПЧ высокого риска, прошли обследование с помощью OESD, LBC и тестов на врВПЧ прошли кольпоскопию в четырех клиниках в Новом Южном Уэльсе, Австралия. В ходе ретроспективного анализа были представлены результаты сравнения с золотым стандартом кольпоскопии и, при необходимости, биопсии. Рассчитаны чувствительность, специфичность, площадь под кривыми рабочей характеристики приемника (ROC) и различия с использованием критериев МакНемара. Доступными для сравнения стали результаты 474 пациентов.
Результаты: Чувствительность при выявлении очагов CIN II+ для OESD, LBC и врВПЧ составила 0,72, 0,81 и 0,88, а специфичность – 0,71, 0,95 и 0,76 соответственно. Скорректированная с учетом возраста и предшествующего лечения площадь под кривой ROC для OESD составила 0,83, для LBC – 0,94 и для теста на врВПЧ – 0,89. Критерии МакНемара не показали существенных различий в чувствительности между OESD и LBC (p = 0,26), а также существенных различий в специфичности между OESD и тестированием на врВПЧ (p = 1,0) среди пациентов, ранее не проходивших лечения.
Выводы: Оптоэлектронное скрининговое устройство продемонстрировало чувствительность, сравнимую с высококачественным цитологическим обследованием, проводимым в клинических условиях. Специфичность сравнима с тестированием на врВПЧ в условиях, приближенных к первичному скринингу. Преимуществами OESD являются немедленный результат и простота использования без необходимости лабораторного оборудования. Это устройство потенциально может стать важным инструментом в профилактике рака шейки матки, особенно в развивающихся странах и странах с ограниченными ресурсами.
Введение
Рак шейки матки является третьим наиболее распространенным видом рака у женщин во всем мире – ежегодно регистрируется около 570 000 новых случаев. В развивающихся странах, где выявляется более 85% новых случаев рака шейки матки, это второй по распространенности рак среди женщин после рака молочной железы [1-4]. Основной причиной рака шейки матки считается персистирующая инфекция папилломавируса человека высокого риска (врВПЧ) в шейке матки [5-7]. Раку шейки матки предшествуют предраковые заболевания, что открывает большие возможности для их скрининга и раннего лечения, а это, в свою очередь, ведет к снижению заболеваемости и смертности от рака шейки матки [8,9]. В развитых странах внедрение организованных программ скрининга на основе эксфолиативной цитологии привело к заметному снижению заболеваемости раком шейки матки [10-12]. Кроме того, усовершенствованные программы скрининга с тестированием на врВПЧ и программы вакцинации против ВПЧ, ведущие к снижению частоты предраковых поражений шейки матки высокой степени предполагают, что уровень заболеваемости будет снижаться и дальше [13].
В странах с низким и средним уровнем дохода (LMIC) успешное внедрение организованного скрининга шейки матки часто становится невозможным из-за отсутствия финансовой поддержки и должным образом подготовленных цитологов, а также плохих лабораторий и служб поддержки программы [14,15]. До тех пор, пока не появится профилактическая вакцина против ВПЧ, действующая на все типы врВПЧ, потребность в скрининге и лечении предраковых поражений шейки матки будет сохраняться. Альтернативные виды скрининга шейки матки, которые проще реализуются, приемлемы для женщин и экономичны, все еще находятся в стадии изучения. К одной из таких альтернатив относится оптоэлектронное устройство, работающее в режиме реального времени. Такие портативные устройства используют электрические и оптические сигналы для выявления нормы или патологии в ткани шейки матки.
Они обеспечивают немедленный результат без необходимости использования лабораторного оборудования или квалифицированных цитологов. В более ранних исследованиях сообщалось, что оптоэлектронные устройства, работающие в режиме реального времени, безопасны и приемлемы [16-18].
В этом ретроспективном исследовании мы оценили эффективность оптоэлектронного устройства для скрининга шейки матки TruScreen как единственного метода скрининга для выявления интраэпителиальной неоплазии шейки матки (CIN 2+). Проведено сравнение его результатов с результатами жидкостной цитологии (LBC) и тестирования на ДНК ВПЧ высокого риска у одних тех же женщин при условии выполнения кольпоскопии и гистологии, выполненной под кольпоскопической навигацией. Оценены чувствительность и специфичность, а также зарегистрированы и оценены все неблагоприятные эффекты оптоэлектронного скринингового устройства.
Материалы и методы
С июня по декабрь 2017 года женщины с выявленными отклонениями в мазке Папаниколау, обратившиеся в клиники Королевского госпиталя (RHW) в Сиднее, в Оринджскую медицинскую службу аборигенов (OAMS) в Ориндже, в Тоттенхэмскую многопрофильную больницу (TMH) в Тоттенхэме и Медицинскую службу аборигенов Пия X (PXAMS) в Мори, находящиеся в Новом Южном Уэльсе в Австралии для проведения кольпоскопии согласились пройти обследование с помощью оптоэлектронного устройства для скрининга шейки матки TruScreen в рамках оценки его клинических характеристик. Этот скрининг проводился в дополнение к стандартному тестированию на врВПЧ и LBC, а также кольпоскопическому обследованию.
Участие могли принимать женщины старше 18 лет, давшие согласие на дополнительную процедуру. Критериями исключения были текущий менструальный период, текущая или недавняя беременность (4 месяца после родов), мазок Папаниколау в течение 6 недель, хирургическое лечение шейки матки в течение последних 3 месяцев, предыдущее облучение малого таза, химиотерапия в течение предыдущих 5 недель, клинические проявления острой или подострой инфекции шейки матки, фотосенсибилизация или предшествующая гистерэктомия.
Все женщины сначала прошли скрининг с использованием портативного устройства TruScreen, после чего был взят образец для LBC и тестирование на врВПЧ. Затем всем женщинам было проведено кольпоскопическое исследование опытным кольпоскопистом и биопсия патологических участков.
Результаты, полученные устройством TruScreen, были доступны сразу и классифицированы как нормальные (нормальный плоский эпителий, цилиндрический эпителий, физиологическая метаплазия или латентные изменения, связанные с ВПЧ) или аномальные (CIN I-III, инвазивный рак). Все образцы для жидкостной цитологии и гистологии были обработаны в отделении анатомической патологии Лабораторной службы Юго-Восточной области (SEAL) в больнице Принца Уэльского, Сидней. Образцы для LBC были классифицированы в соответствии с австралийской модифицированной системой Bethesda [19]. Результаты биопсии были классифицированы как нормальные, CIN I, CIN II, CIN III, AIS и инвазивная карцинома (плоскоклеточная, аденокарцинома, аденосквамозная карцинома).
Образцы были проверены на наличие ДНК ВПЧ высокого риска с использованием Cobas HPV Assay (Roche Cobas 4800) и классифицированы как ВПЧ-отрицательные, ВПЧ-16-положительные, ВПЧ-18-положительные, ВПЧ-положительные «другие». Результаты обследования устройством TruScreen были известны только команде, присутствовавшей при клиническом осмотре. Все осложнения и неблагоприятные исходы были зарегистрированы.
Описание TruScreen.
Оптоэлектронное устройство TruScreen измеряет физические свойства ткани. Сравнивая характеристики интересующей ткани с параметрами известных типов тканей, прибор может определить их структуру. Таким способом удается выявить предраковые и раковые изменения шейки матки. Используются два типа физических измерений – оптические и электрические.
Устройство состоит из ручного зонда с беспроводной индукционной зарядной подставкой. Длина устройства от основания до наконечника примерно 37 см (Рис. 1, 2, 3). Часть зонда, которая входит во влагалище, имеет длину 120 мм и диаметр наконечника примерно 5 мм. Система включает в себя одноразовый датчик (SUS) в оболочке, закрывающей зонд и увеличивающей диаметр наконечника приблизительно до 6,5 мм.

Рис. 1. Портативное устройство TruScreen ultra
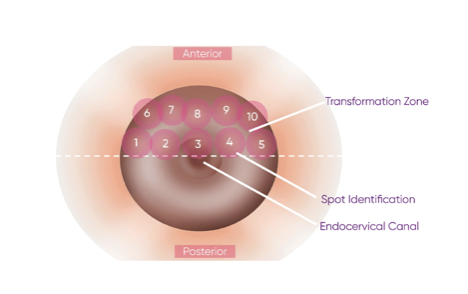
Рис. 2. Схема зондирования из руководства по эксплуатации TruScreen
Зондирование внешней области эктоцервикса следует начинать с точки 1 с левой стороны и продолжать в горизонтальном направлении слева направо. Пройдите два ряда, чтобы обеспечить полное покрытие передней части эктоцервикса.
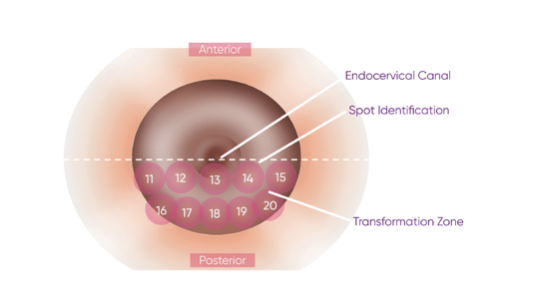
Рис. 3. Задняя часть эктоцервикса должна обследоваться в том же горизонтальном направлении слева направо, как показано выше.
Наконечник зонда исследует ткань, периодически воздействуя на нее низкими уровнями оптической и электрической энергии. Интерпретация реакции тканей шейки матки в режиме реального времени достигается путем автоматического сравнения с каталогом характеристик тканей, хранящимся в цифровом формате.
Устройство измеряет кривые прямого и отраженного света, диффузного отражения и затухания электрических волн от тканей шейки матки. Оно оценивает реакцию поверхностных эпителиальных клеток, а также выявляет изменения в эпителиальном базальном слое и стромальных клетках. Эти изменения включают увеличенные клеточные ядра, повышенную плотность цитоплазмы, усиленное кровообращение и изменения в кровеносных сосудах, а также изменения, возникающие при опухолевых поражениях.
Устройство питается от ионно-литиевой батареи безопасной для пациента и подает несколько электрических импульсов длительностью в миллисекунды. На одно "наблюдение" приходится двадцать семь импульсов, а в секунду производится четырнадцать измерений. Эти импульсы очень низкой энергии ниже нормального порога ощущений.
Оптические измерения работают в видимом и ближнем инфракрасном спектре. Светоизлучающие диоды имеют выходную мощность в диапазоне 20-200 мкВт. Интенсивность света намного ниже, чем у кольпоскопа. Четыре светодиода используются для излучения света с тремя дискретными длинами волн: зеленый 520 ± 10 нм, ближний и дальний красный 660 ± 10 нм и инфракрасный 936 ± 15 нм. На одно «наблюдение» светодиоды работают примерно одну сотую секунды, и в секунду выполняется примерно 14 «измерений».
Алгоритм идентификации тканей представляет собой экспертную систему, сопоставляющую образцы. Конечный результат является результатом работы алгоритма на трех уровнях - уровне наблюдения, уровень "точки" и общий результат обследования пациента. При каждом "наблюдении" ткани измеряется около 70 оптических и электрических параметров.
«Точка» определяется как серия «наблюдений», сделанных наконечником устройства TruScreen в одном месте на шейке матки. По информации с экрана аппарата оператор перемещает кончик зонда TruScreen вокруг эктоцервикса, вывернутой части эндоцервикса и дистального эндоцервикального канала (Рис. 2, 3). Для покрытия всего плоскоклеточного и цилиндрического соединения каждого пациента требуется минимум 15 точек. Во время каждого обследования аппарат может выполнить измерения не более, чем 32 точек. Только после выполнения минимум 15 точечных измерений оператор может завершить исследование и разрешить обработку данных пациента с помощью алгоритма. Устройство TruScreen - это экспертная система, и, как и все экспертные системы, алгоритм распознавания необходимо было "обучить". Результаты оптических и электрических измерений сравниваются с «золотым стандартом», полученным в результате обработки накопленной ранее информации.
Для обучения алгоритма во время разработки TruScreen также были получены обширные справочные Материалы, включая результаты кольпоскопических и гистологических исследований.
Статистический анализ.
Статистический анализ проводился с использованием программного обеспечения SAS. (SAS версия 9.4, SAS Inc, США). Результаты чувствительности и специфичности были рассчитаны, а точность классификации определялось с помощью кривых ROC для всех трех скринингов модальности. Тест МакНемара использовался для получения связанного значения p для значимости различий в чувствительности и специфика.
Результаты
Участвовало всего 506 женщин. Из этих пациенток 498 были успешно обследованы с помощью оптоэлектронного устройства, никаких побочных эффектов не возникло. У 8 пациенток оптоэлектронное исследование было неудачным из-за перезагрузки прибора при первой попытке скрининга. В общей сложности 23 пациентки были исключены по следующим причинам: 9 пациенток дважды проходили обследование, 10 пациенток проходили обследование в течение трех месяцев после лечения/пункционной биопсии, 3 пациентки проходили обследование менее, чем через четыре месяца после родов и у 1 пациентки было выявлено тяжелое течение острого цервицита.
Из последних 475 пациенток 246 получили направление в связи с первым аномальным мазком Папаниколау, а 229 проходили кольпоскопическое обследование в связи с предшествующим лечением CIN. 393 пациентки были из RHW, 44 из PXAMS, 28 из OAMS и 2 из TMH. Средний возраст составил 37,9 лет в диапазоне от 19 до 82 лет, стандартное отклонение 11,5 лет. В отношении оптоэлектронного устройства и тестирования на врВПЧ было доступно 475 результатов для сравнения с золотым стандартом, в то время как для LBC было доступно 474 результата.
Гистология кольпоскопически направленных биопсий была следующей: изменения ВПЧ n = 35, CIN I n = 28, CIN II n = 25, CIN III n = 48, микроинвазивная плоскоклеточная карцинома n = 3 и аденокарцинома in situ n = 1. См. блок-схему на Рис. 4.
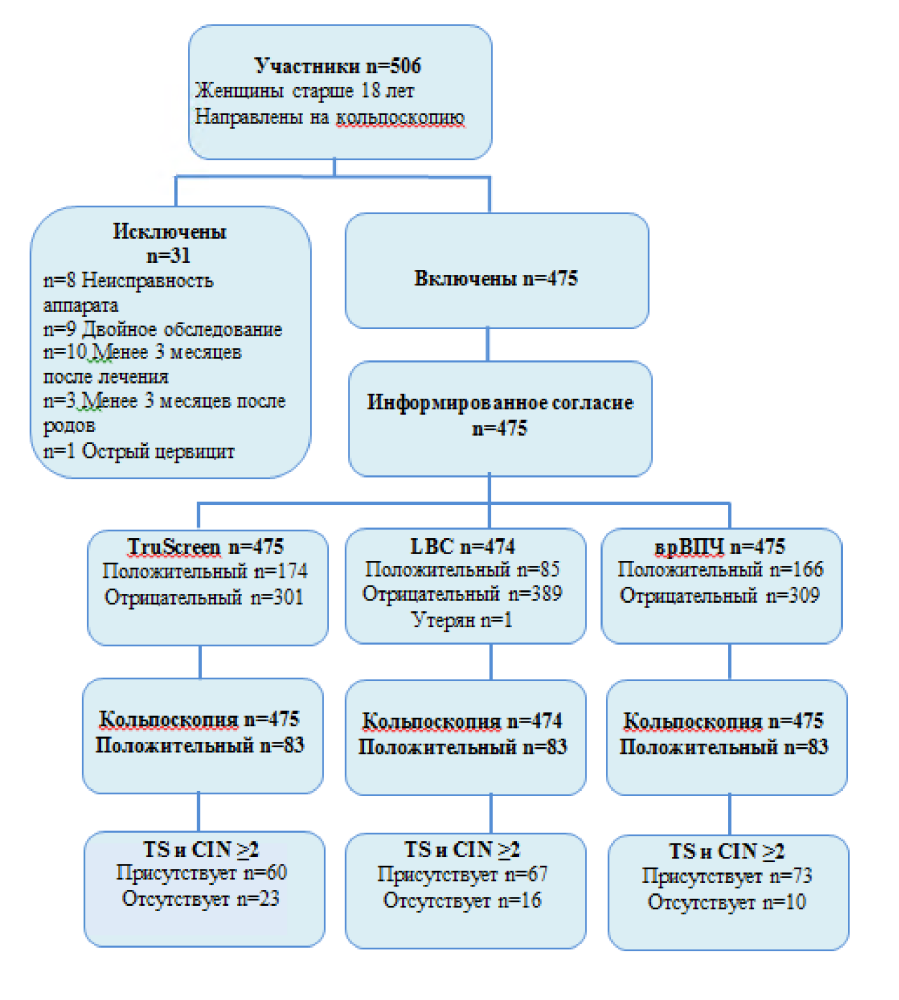
Рис. 4. Блок-схема
Сравнение эффективности оптоэлектронного устройства, тестирования на ВПЧ и LBC.
Используя результаты гистологии, полученные под кольпоскопической навигацией в качестве золотого стандарта, общая чувствительность оптоэлектронного устройства, LBC и тестирования на ВПЧ при обнаружении очагов CIN II+ составила 0,72, 0,81 и 0,88 соответственно; специфичность составила 0,71, 0,95 и 0,76 соответственно (Таблица 1).
Таблица 1. Чувствительность и специфичность различных методов скрининга – в целом, без предшествующего лечения, после предшествующего лечения.
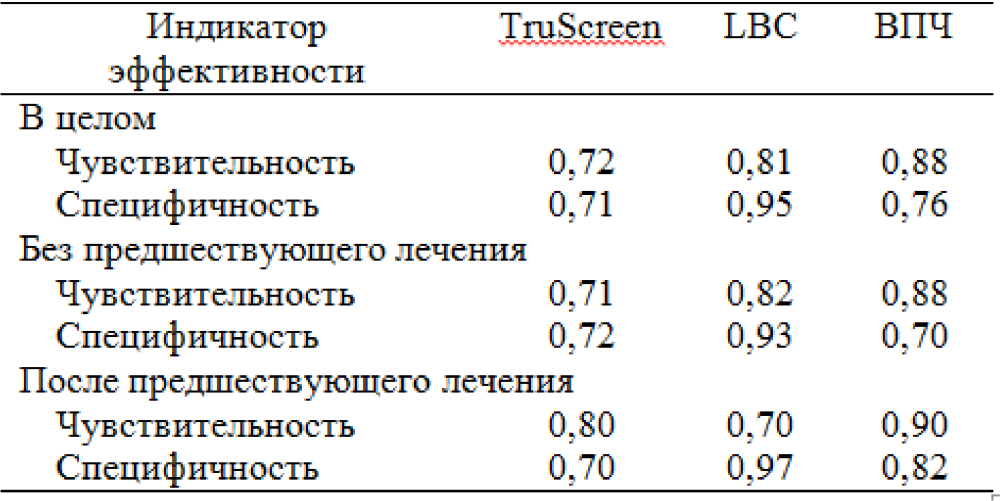
Результаты для пациенток без предшествующего лечения, которые более точно приближены к чувствительности первичного скрининга, составили 0,71 для TruScreen, 0,82 для LBC и 0,88 для ВПЧ, а специфичность составила 0,72, 0,93 и 0,70 соответственно.
Для повторного скрининга чувствительность составила 0,80 для TruScreen, 0,70 для LBC и 0,90 для теста на ВПЧ, а специфичность 0,70, 0,97 и 0,82 соответственно.
Место проведения скрининга и опыт специалиста, проводящего скрининг, не оказали существенного влияния на результат теста TruScreen (результаты не показаны).
Нескорректированная площадь под кривыми ROC составила 0,71 для TruScreen, 0,82 для тестирования на ВПЧ и 0,88 для LBC; скорректированная по возрасту площадь под кривыми ROC составила 0,74, 0,85 и 0,91 соответственно. Площадь под кривой ROC с поправкой на возраст и предшествующее лечение составила 0,83, 0,89 и 0,94 соответственно. См. Рис. 5 для кривых ROC, скорректированных по возрасту и предыдущему лечению.
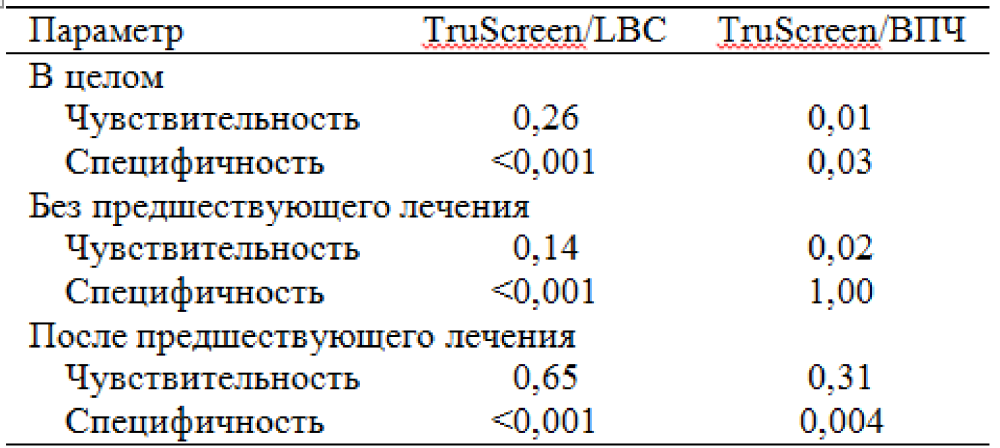
Критерий различий МакНемара не показал статистически значимых различий для обнаружения очагов CIN II+ между чувствительностью TruScreen и LBC, p = 0,26, но показал, что LBC значительно более специфична. Эти результаты были одинаковыми в целом, у тех, кто ранее не лечился, и у тех, кто ранее лечился. Тест на ВПЧ был более чувствителен, чем обследование TruScreen, в целом и у тех, кто ранее не лечился, и был столь же специфичен у тех, кто ранее не лечился (p = 1,0). Подробнее см. в Таблице 2.
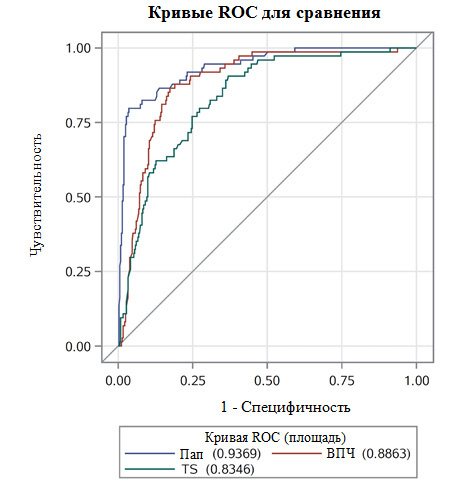
Рис. 5. Скорректированные по возрасту и предыдущему лечению комбинированные кривые ROC для сравнения различных методов скрининга.
Таблица 2. Критерий различий МакНемара между методами скрининга шейки матки (значение р) в целом, без предшествующего лечения, после предшествующего лечения.
Обсуждение
В этом исследовании мы оценили эффективность оптоэлектронного устройства TruScreen в условиях исследования для обнаружения поражений шейки матки CIN 2+ с использованием золотого стандарта гистологии, полученной под кольпоскопической навигацией.
Эффективность TruScreen сравнивали с LBC и тестированием на ДНК ВПЧ высокого риска. Все пациентки дали согласие на использование оптоэлектронного скринингового устройства. Скрининг хорошо переносился, о побочных эффектах не сообщалось. Положительное впечатление на пациентов оказали результаты, полученные в режиме реального времени.
Чувствительность обнаружения поражений CIN 2+ с помощью TruScreen в общей группе составила 0,71, что сравнимо с результатами чувствительности, описанными в более ранних исследованиях оптоэлектронных устройств Singer et al. [18] 0,70 и Lee et al. [20] 0,77. Систематический обзор и мета-анализ девяти китайских исследований, включавших 2730 пациентов с 567 случаями неоплазии шейки матки, показали совокупную чувствительность оптоэлектронного устройства (TruScreen) 0,76 [21].
В индонезийском исследовании чувствительность составила 0,76 [22]. Оба этих исследования включали чувствительность для всех CIN и не классифицировали их результаты на выявление поражений CIN 2+. Ozgu et al. [23] и Pruski et al. [24] сообщили о чувствительности оптоэлектронного устройства TruScreen 0,86 и 0,90.
На чувствительность оптоэлектронного скрининга может влиять невозможность обнаружения очень маленьких поражений или исключительно эндоцервикальных поражений. Для повышения чувствительности можно использовать оптоэлектронные устройства в сочетании с цитологией, как описано Rahmadhany [22] и Singer [18]. В этих исследованиях чувствительность значительно увеличилась до 92,8%. Однако, сочетание оптоэлектронного скрининга с цитологией сводит на нет основные преимущества низкой стоимости и немедленной доступности результата.
В нашем исследовании специфичность TruScreen «в целом» составила 0,71, что сравнимо с совокупной специфичностью 0,69, описанной Yang et al. [21]. Специфичность TruScreen также была сравнима со значением 0,76, полученным в этом исследовании при тестировании на врВПЧ, но оба результата оказались меньше значения 0,94, полученного с помощью жидкостной цитологии. Последствием более низкой специфичности является более высокий уровень ложноположительных результатов и, следовательно, большее число направлений на дальнейшее цитологическое обследование и/или кольпоскопию + биопсию.
В этом исследовании LBC показала себя очень хорошо. К сожалению, во многих условиях LMIC использование LBC и успешное внедрение организованного цитологического скрининга рака шейки матки остаются невозможными из-за высокой стоимости, отсутствия обученных цитологов и плохой инфраструктуры лабораторий и программ [14,15]. Напротив, чувствительность оптоэлектронного устройства TruScreen оказалась сравнимой с чувствительностью, полученной с помощью LBC в идеальных клинических условиях. Специфичность TruScreen оказалась сравнимой со специфичностью тестирования на врВПЧ в группе без предшествующего лечения (критерий различий Макнемара: p = 1,0). Эта группа приближена к условиям первичного скрининга. Учитывая все это, такое устройство потенциально может стать важным инструментом в условиях первичного скрининга, особенно в развивающихся странах и странах с ограниченными ресурсами.
Существует риск пропуска эндоцервикальных поражений из-за конструкции сенсора TruScreen, который сильно экранирует видимую поверхность шейки матки. В нашем исследовании одно эндоцервикальное поражение, идентифицированное с помощью жидкостной цитологии, теста на ДНК ВПЧ и кольпоскопии, также было выявлено с помощью TruScreen, предположительно потому, что оно находилось низко в канале и было доступно для зонда. В будущих устройствах неплохо бы применять зонд, который будет вводиться в канал и излучать электрические импульсы и световые волны горизонтально.
Сильной стороной этого исследования является высокое качество условий, в которых проводился скрининг с помощью LBC, тестирования на врВПЧ и золотого стандарта кольпоскопии. Их оптимальная эффективность дает надежный результат по сравнению с оптоэлектронным устройством. Ограничением исследования является то, что оно проводилось в популяции, получившей направления на скрининг, что удобно для оценки эффективности оптоэлектронного устройства, но результаты необходимо также подтвердить в популяции с базовыми условиями.
В поисках более объективного и воспроизводимого скрининга рака шейки матки применяется искусственный интеллект для идентификации поражений шейки матки на изображениях, полученных во время кольпоскопии [25]. Hu et al. [26] провели закрытое исследование, в котором использовали анализатор изображений, выполнявший «автоматическую визуальную оценку» шейки матки в качестве метода первичного скрининга. В участвующей когорте они обнаружили превосходящую чувствительность для обнаружения CIN 2+ [26]. Потенциальная комбинация ИИ-TruScreen позволяет применять оптоэлектронный скрининг для определения местоположения поражений шейки матки в качестве помощи при кольпоскопии (Z-Scan). Это требует анализа всех точек и оповещений об обнаруженных отклонениях с указанием предполагаемой серьезности процесса. Единственным действующим применением устройства TruScreen является скрининг неоплазии шейки матки. В этом применении устройство дает «отрицательный» или «положительный» результат в отношении выявленной аномалии, что приводит к соответствующему клиническому направлению, в частности на кольпоскопию и/или лечение. В этом контексте ИИ применяется ограниченно: хотя это многообещающий способ улучшить скрининг рака шейки матки, такое же ограничение применимо и к скринингу эндоцервикальных поражений.
Выводы
Оптоэлектронное устройство TruScreen продемонстрировало чувствительность, сравнимую с высококачественным цитологическим обследованием, проводимым в клинических условиях, и специфичность, сравнимую с тестированием на врВПЧ в условиях, приближенных к первичному скринингу. Оно может стать важным инструментом в профилактике рака шейки матки, особенно в развивающихся странах и странах с ограниченными ресурсами, благодаря получению немедленных результатов, объективному и неинвазивному характеру обследования и относительной простоте управления устройством. Требуются дальнейшие исследования в полевых условиях для оценки его характеристик и эффективности в условиях первичного скрининга.
Вклад авторов
MC, LP—Концептуализация исследования; CV, JH, MC, LP, MB, JV—Создание базы данных и сбор данных; SM, JV, MC, CV, JH—Анализ и интерпретация данных; JV, MC, SM—Подготовка первоначального проекта; MC, LP, SM —Рецензия на рукописи. Все—Одобрение рукописи.
Одобрение этических норм и согласие на участие
Проект здравоохранения NSW номер 2021/ETH00445 Информационной системы управления исследованиями и этическими нормами (REGIS) был рекомендован как деятельность по обеспечению или повышению качества (QA/QI), не требующая независимой этической проверки. Все женщины согласились пройти обследование с помощью оптоэлектронного устройства для скрининга шейки матки TruScreen в рамках оценки его клинической эффективности.
Благодарности
Это исследование было бы невозможно без человека, которому авторы хотели бы выразить свою благодарность: Невилл Ф. Хакер, директор Центра гинекологического рака, Королевский госпиталь для женщин, Рандвик, Новый Южный Уэльс, Австралия.
Финансирование
Это исследование не получало внешнего финансирования.
Конфликт интересов
MC является оплачиваемым медицинским консультантом компании TruScreen Limited, JH был сотрудником TruScreen Limited во время исследования, CV является оплачиваемым консультантом TruScreen Limited. Другие авторы заявляют об отсутствии конфликта интересов.
Список литературы
[1] Arbyn M, Castellsagué X, de Sanjosé S, Bruni L, Saraiya M, Bray F, et al. Worldwide burden of cervical cancer in 2008. Annals of Oncology. 2011; 22: 2675–2686.
[2] Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018 GLOBOCAN estimates of incidence and mortality for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 2018; 68: 394-424.
[3] Torre LA, Siegel RL, Ward EM, Jemal A. Global Cancer Incidence and Mortality Rates and Trends–An Update. Cancer Epidemiology Biomarkers & Prevention. 2016; 25: 16–27.
[4] Ferlay J, Shin H, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. International Journal of Cancer. 2010; 127: 2893–2917.
[5] zur Hausen H. Human papillomaviruses in the pathogenesis of anogenital cancer. Virology. 1991; 184: 9–13.
[6] Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. The Journal of Pathology. 1999; 189: 12–19.
[7] Bosch FX, Lorincz A, Muñoz N, Meijer CJLM, Shah KV. The causal relation between human papillomavirus and cervical cancer. Journal of Clinical Pathology. 2002; 55: 244–265.
[8] Denny L, Kuhn L, Hu C, Tsai W, Wright TC. Human papillomavirus-based cervical cancer prevention: long-term results of a randomized screening trial. Journal of the National Cancer Institute. 2010; 102: 1557–1567.
[9] Sankaranarayanan R. Screening for cancer in low- and middleincome countries. Annals of Global Health. 2014; 80: 412–417.
[10] Lăără E, Day NE, Hakama M. Trends in mortality from cervical cancer in the Nordic countries: association with organised screening programmes. Lancet. 1987; 1: 1247–1249.
[11] Anderson GH, Boyes DA, Benedet JL, Le Riche JC, Matisic JP, Suen KC, et al. Organisation and results of the cervical cytology screening programme in British Columbia, 1955-85. British Medical Journal. 1988; 296: 975–978.
[12] Quinn M, Babb P, Jones J, Allen E. Effect of screening on incidence of and mortality from cancer of cervix in England: evaluation based on routinely collected statistics. British Medical Journal. 1999; 318: 904–908.
[13] Cohen PA, Jhingran A, Oaknin A, Denny L. Cervical cancer. Lancet. 2019; 393: 169–182.
[14] Tsu VD, Levin CE. Making the case for cervical cancer prevention: what about equity? Reproductive Health Matters. 2008; 16: 104–112.
[15] Sankaranarayanan R, Budukh AM, Rajkumar R. Effective screening programmes for cervical cancer in low- and middle-income developing countries. Bulletin of the World Health Organization. 2001; 79: 954–962.
[16] Long S, Lei W, Feng Y, Lv D, Cai Y, Yang P. The feasibilities of TruScreen for primary cervical cancer screening: a self controlled study. Archives of Gynecology and Obstetrics. 2013; 288: 113–118.
[17] Pruski D, Kedzia W, Przybylski M, Jozefiak A, Kedzia H, Spaczynski M. Assesment of real optoelectronic method in the detection of cervical intraepithelial neoplasia. Ginekologia polska. 2008; 79: 342–346. (In Polish)
[18] Singer A, Coppleson M, Canfell K, Skladnev V, Mackellar G, Pisal N, et al. A real time optoelectronic device as an adjunct to the Pap smear for cervical screening: a multicenter evaluation. International Journal of Gynecological Cancer. 2003; 13: 804–811.
[19] Solomon D, Davey D, Kurman R, Moriarty A, O’Connor D, Prey M, et al. The 2001 Bethesda System: terminology for reporting results of cervical cytology. JAMA. 2002; 287: 2114–2119.
[20] Lee SJ, Bae JH, Kim JH, Lee SH, Namkoong SE, Park JS. A realtime optoelectronic device in screening of cervical intraepithelial meoplasia. Journal of Women’s Medicine. 2009; 2: 23–28.
[21] Yang H, Zhang X, Hao Z. The diagnostic accuracy of a real-time optoelectronic device in cervical cancer screening: a PRISMAcompliant systematic review and meta-analysis. Medicine. 2018; 97: e11439.
[22] Rahmadhany R, Indarti J. A real-time optoelectronic device in screening of precancerous cervical lesion. Indonesian Journal of Obstetrics and Gynecology. 2015; 3: 117–120.
[23] Özgü E, Yıldız Y, Özgü BS, Öz M, Danışman N, Güngör T. Efficacy of a real time optoelectronic device (TruScreen™) in detecting cervical intraepithelial pathologies: a prospective observational study. Journal of the Turkish German Gynecological Association. 2015; 16: 41–44.
[24] Pruski D, Przybylski M, Kedzia W, Kedzia H, Spaczynski M, Jagielska-Pruska J. Optoelectronic method for detection of cervical intraepithelial neoplasia and cervical cancer. Opto-electronics Review. 2011; 19: 478–485.
[25] Shiraz A, Crawford R, Egawa N, Griffin H, Doorbar J. The early detection of cervical cancer. the current and changing landscape of cervical disease detection. Cytopathology. 2020; 31: 258–270.
[26] Hu L, Bell D, Antani S, Xue Z, Yu K, Horning MP, et al. An observational study of deep learning and automated evaluation of cervical images for cancer screening. JNCI: Journal of the National Cancer Institute. 2019; 111: 923–932.
