Оценка работы TruScreen у пациентов с ВПЧ высокого риска
Оценка работы TruScreen (система скрининга с использованием искусственного интеллекта для обнаружения рака шейки матки) у пациентов с ВПЧ высокого риска
Аннотация
Предыстория: оценить пользу системы искусственного интеллекта для скрининга рака шейки матки TruScreen (TS) у пациентов с вирусом папилломы человека (ВПЧ) высокого риска в клинических условиях.
Методы: Ретроспективно проанализировано триста восемнадцать пациентов с ВПЧ высокого риска в гинекологической клинике нашей больницы с мая 2020 года по июнь 2021 года. Кольпоскопия проводилась по клиническим показаниям.
Результаты: Среди 318 пациентов 203 были TS-отрицательными и 115 - TS-положительными, из них 84 были направлены на кольпоскопию и возможную биопсию. Среди 318 патентов 74,53% (237/318) имели один тип ВПЧ, а 25,47% (81/318) имели более двух типов ВПЧ. Что касается типов ВПЧ, в первую пятерку вошли 52, 58, 51, 56 и 16. На ВПЧ 52 типа приходилось 27,4% (87/318), за ним следовал ВПЧ 58 типа, на который приходилось 17,30% (55/318). Всего кольпоскопию прошли 84 пациента. Отрицательная прогностическая ценность скрининга TS и цитологического теста ThinPrep (TCT) на рак шейки матки и предраковые поражения составила 33,33% и 16,90% соответственно. Положительная прогностическая ценность составила 88,41% и 92,31% соответственно. Чувствительность составила 85,92% и 16,90% соответственно. Специфичность составила 38,46% и 92,31% соответственно. Среди 251 не-16/18 ВПЧ-положительных пациентов с TCT -отрицательным интраэпителиальным поражением или злокачественным новообразованием (NILM) 49 прошли кольпоскопию. Положительная прогностическая ценность TS для рака шейки матки и предраковых поражений составила 84,78%, а чувствительность - 92,86%.
Выводы: Это исследование продемонстрировало, что в клинических условиях TS имел более высокую чувствительность, чем TCT при скрининге рака шейки матки, но меньшую специфичность, чем TCT. В популяции без ВПЧ 16/18 с результатом по TCT NILM скрининг TS можно рассматривать как имеющий потенциал для клинического лечения. Однако текущий размер исследовательской выборки был небольшим, и дальнейшие исследования необходимо проводить с большим размером выборки.
Ключевые слова: скрининг рака шейки матки; ВПЧ; ТруСкрин; жидкостная цитология; выборка
1. Введение
Рак шейки матки – распространенная злокачественная опухоль, которая серьезно угрожает жизни и здоровью женщин во всем мире. Статистика Global Cancer Report за 2018 год показала, что количество новых случаев рака шейки матки каждый год составляет около 570 000, а количество смертей — около 311 000. Ежегодное число новых случаев рака шейки матки в Китае составляет около 25% от общего числа в мире, составляя примерно 131 500 случаев [ 1 ]. Однако текущий уровень скрининга рака шейки матки в Китае составляет всего 19% [ 2 ], что далеко от принятой цели в 90% населения, необходимой для профилактики и лечения рака шейки матки [ 3 ]. Поэтому предпринимаются усилия по поиску альтернативных, надежных и экономически эффективных методов расширения скрининга.
В настоящее время традиционными методами скрининга являются жидкостная цитология и выявление вируса папилломы человека. Низкая чувствительность технологии жидкостной цитологии может привести к ошибочному диагнозу, и ее успех зависит от опыта и технического уровня специалиста по цитологическим исследованиям [ 4 ]. Чувствительность теста на наличие вируса папилломы человека (ВПЧ) высока, но результаты содержат большое количество «транзиторных» инфицированных людей, что приводит к низкой специфичности [ 5 ]. Появление системы скрининга рака шейки матки с искусственным интеллектом (TruScreen, TS) в качестве нового метода скрининга привносит новые технологии в скрининг рака шейки матки [ 4 ].
Принцип TS — это технология скрининга при помощи искусственного интеллекта в режиме реального времени, основанная на миллионах точек данных из стандартизированной базы данных гистопатологических образцов. Он передает световые сигналы низкой интенсивности и электрические импульсы для стимуляции шейки матки при контакте с поверхностью шейки матки через нанофотоэлектрические биосенсоры. На основе изменений оптических свойств тканей и импеданса в образованиях, вызванных патофизиологическими изменениями при раке шейки матки и предраковых заболеваниях, система собирает исходные данные обратной связи фотоэлектрических сигналов, которые будут фильтроваться, отбираться и анализироваться на компьютере для извлечения наиболее важных данных у конкретного пациента. Затем они сравниваются со стандартными гистопатологическими данными в базе прибора с помощью уникального алгоритма, который моделирует процесс распознавания патологии в тканях ведущими патоморфологами, идентифицирует и классифицирует ткани шейки матки, а также различает аномальные и нормальные ткани. Этот метод позволяет исследовать не только эпителиальную ткань поверхности шейки матки, но также проникнуть в базальные и стромальные слои эпителиальной ткани шейки матки для обнаружения изменений в глубоком слое. Этот метод фокусируется на морфологии клеток и изменениях в ткани.
Поскольку метод TS не требует отбора проб и получает параметры только путем сканирования, гинекологи могут действовать независимо от других служб. Преимущества TS заключаются в том, что скрининг становится простой, объективной, немедленной и не инвазивной процедурой. Эти свойства привлекли внимание ученых для проведения дальнейших исследований по использованию TS в скрининге рака шейки матки [ 4 ].
Согласно «Экспертному консенсусу по вопросам скрининга и лечения рака шейки матки в Китае», опубликованному в Китайском клиническом журнале акушерства и гинекологии в 2017 году, при комбинации цитологического исследования и теста на ВПЧ, пациенты с отрицательным результатом по цитологии и с положительным по ВПЧ 16/18 типа должны быть направлены на кольпоскопию, а цитологически отрицательным пациентам с инфекцией, отличной от ВПЧ 16/18 типа, рекомендуется пройти повторное тестирование только через 1 год. Однако, клиническое ведение пациентов с ВПЧ, отличным от 16/18 типа, является более трудным [ 6 ]. Целью данного исследования является изучение преимуществ и недостатков TS по сравнению с традиционными методами скрининга, а также того, можно ли рассматривать технологию TS в качестве основы для стратифицированного ведения ВПЧ-позитивных пациентов, не 16/18 типа, с результатами цитологического теста (TCT), выявившего негативное интраиэпителиальное поражение или злокачественное новообразование (NILM).
2. Материалы и методы
2.1. Сбор клинических данных
Были собраны клинические данные о 318 пациентках с ВПЧ высокого канцерогенного риска, прошедших скрининг шейки матки в клинике акушерства и гинекологии больницы Аньжень с 1 мая 2020 г. по 30 июня 2021 г.
Причинами обращения за медицинской помощью были плановый медицинский осмотр и гинекологические заболевания (включая аномальные бели, зуд вульвы, контактные кровотечения, аномальные маточные кровотечения и т. д.). Критерии исключения были следующие: (1) острый вагинит; (2) острый цервицит; (3) кровотечения из репродуктивных путей; (4) состояние в течение 3 месяцев после родов; (5) конизация шейки матки/физиотерапия в течение 6 месяцев.
Пациенты были направлены на кольпоскопию при следующих условиях: (1) положительный результат на ВПЧ16/18; (2) TS положительный; (3) TCT показал плоскоклеточное интраэпителиальное поражение низкой степени злокачественности (LSIL) или выше; (4) TCT показал атипичные плоские клетки неопределенного значения (ASCUS) и положительный результат на ВПЧ; (5) персистирующая ВПЧ-инфекция более 1 года.
У пациентов, направленных на кольпоскопию, биопсию проводили под контролем кольпоскопа, а биоптат направляли на гистологическое исследование (рис. 1 ). Процедуры выполнялись разными врачами, все из них были обучены кольпоскопии и не были осведомлены о других результатах анализов пациентов. Это исследование было рассмотрено Комитетом по этике Пекинской больницы Аньчжэнь Столичного медицинского университета (номер партии: 2021113X).
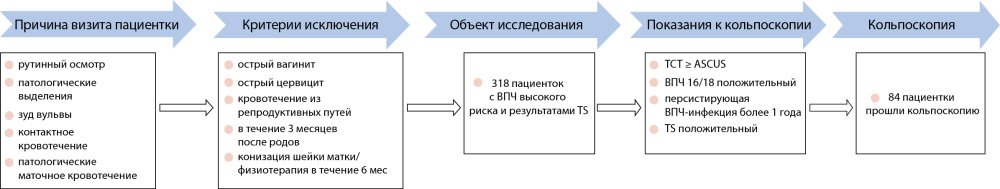
Рис. 1. Процедура получения клинических данных. ТСТ - тонкослойный цитологический тест; ВПЧ - вирус папилломы человека; ТС - TruScreen; ASCUS - атипичные плоские клетки неопределенного значения.
2.2. Инструменты и оборудование
Типирование ВПЧ определяли с помощью флуоресцентной полимеразной цепной реакции (ПЦР) (Shanghai ZJ Bio-Tech Co., Ltd., Шанхай, Китай). Пациенты были обследованы при помощи системы скрининга рака шейки матки TruScreen (TS), разработанной Truscreen Pty Ltd., Сидней, Австралия.
Оператор использовал одноразовые фотоэлектрические сенсоры для исследования не менее 20 участков поверхности шейки матки в порядке, указанном в инструкции к оборудованию.
Результаты были получены в режиме реального времени. Результаты определялись как: (1) нормальные (аномальные клетки в шейке матки не обнаружены) или (2) аномальные (в шейке матки обнаружены аномальные клетки).
2.3. Интерпретация
Результат TS определялся как: (1) нормальный (аномальные клетки на шейке матки не обнаружены) или (2) аномальный (на шейке матки обнаружены аномальные клетки).
К отрицательному результату TCT относили цитологический результат < ASCUS, включающий: отсутствие интраэпителиальных патологических или злокачественных клеток (NILM), доброкачественные реактивные изменения, хронические воспаления и атрофию эпидермальных клеток. Положительный результат TCT по цитологии определялся как ≥ ASCUS , и включал ASCUS атипичные плоские клетки, не исключающие плоскоклеточное интраэпителиальное поражение высокой степени (ASCUS-H), LSIL, плоскоклеточное интраэпителиальное поражение высокой степени (HSIL) и атипичные железистые клетки (AGC).
Для интерпретации результатов обследования патологические результаты биопсии LSIL или выше определялись как «аномальные». Ссылаясь на консенсус Американского колледжа патологов и Американского общества кольпоскопии и патологии шейки матки, патологические результаты были разделены на следующие три типа: (1) нормальные (включая нормальный плоский эпителий, нормальный цилиндрический эпителий и хронический цервицит); (2) цервикальная интраэпителиальная неоплазия, включая цервикальную интраэпителиальную неоплазию низкой степени (LSIL, т.е. первичная CIN1), цервикальную интраэпителиальную неоплазию высокой степени (HSIL, т.е. первичная CIN3 и частичная CIN2); (3) раннюю инвазивную карциному и инвазивную карциному.
Окончательный патологоанатомический диагноз был установлен опытным патоморфологом, который не был осведомлен о других результатах обследования.
Классификация патологоанатомических данных включала воспаление, CIN1 , CIN2, CIN3 и рак шейки матки.
2.4. Статистический анализ
Статистический анализ проводился с использованием SPSS 23.0 (IBM Corp., Армонк, Нью-Йорк, США) и -платформы анализа FreeStatistics. Описание скорости выполнялось с помощью SPSS 23.0. Чувствительность, специфичность, положительную прогностическую ценность, отрицательную прогностическую ценность и площадь под кривой (AUC) каждого метода скрининга определяли с использованием статистического программного обеспечения R (версия 4.2.2, http://www.R-project.org , The R Foundation) и платформу анализа бесплатной статистики (версия 1.8, FreeClinical Medical Technology Co., Ltd., Пекин, Китай).
3. Полученные результаты
Возраст пациентов был от 21 до 73 лет, средний возраст 37,21 год. Среди 318 пациентов 74,53% (237/318) были инфицированы одним типом ВПЧ, а 25,47% (81/318) были инфицированы более чем двумя типами ВПЧ. Что касается типов ВПЧ, то в первую очередь вошли 5 типов. 52, 58, 51, 56 и 16.
Наибольшую долю имел ВПЧ 52 типа — 27,4% (87/318), за ним ¬следовал ВПЧ 58 типа — 17,30% (55/318) (рис. 2 ). По возрастному распределению на пике находились 27-32-летние (рис. 3).
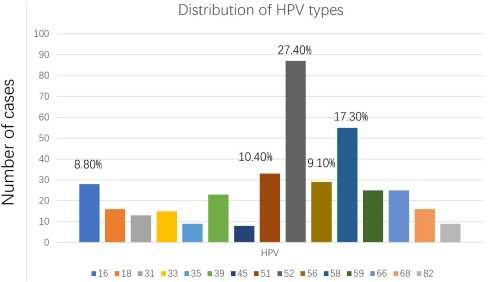
Рис. 2. Распределение типов вируса папилломы человека (ВПЧ).
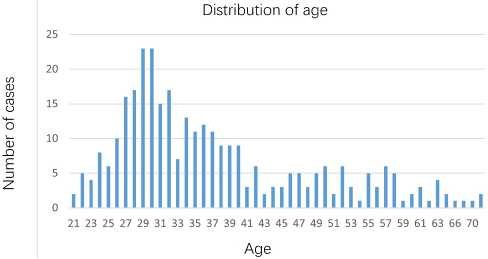
Рис. 3. Возрастное распределение.
Среди 318 обследованных пациентов 39 пациентов имели ВПЧ 16/18 типа высокого риска (врВПЧ) и 279 пациентов не имели ВПЧ 16/18 типа. Все 318 пациентов прошли обследование при помощи TS, из них 115 были TS-положительными и 203 были TS-отрицательными. На кольпоскопию было направлено 84 пациента, при этом по результатам кольпоскопической биопсии у 13 пациентов было выявлено хроническое воспаление, 15,48% (13/84), у 51 пациента - LSIL, 60,71% (51/84), у 20 пациентов - CIN2-3, 23,81% (20/84) (табл. 1 ).
Таблица 1. Цитологическое исследование и стратифицированное гистологическое распределение результатов ТС (%).
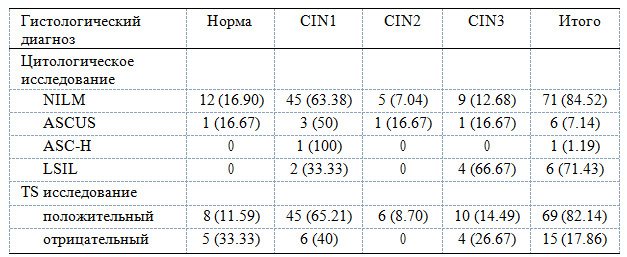
Примечание: NILM - негативное интраэпителиальное поражение или злокачественная опухоль; ASCUS - атипичные плоские клетки неопределенного значения; ASC-H - атипичные плоские клетки не позволяют исключить высокой степени плоскоклеточное интраэпителиальное поражение; LSIL – низкой степени плоскоклеточное интраэпителиальное поражение
Отрицательная прогностическая ценность скрининга TS и TCT для рака шейки матки и предраковых заболеваний составила 33,33% и 16,90% соответственно. Положительная прогностическая ценность составила 88,41% и 92,31% соответственно. Чувствительность составила 85,92% и 16,90% соответственно. Специфичность составила 38,46% и 92,31% соответственно. AUC TS составила 62,19% (¬62,2–76,54%) , а TCT — 53,74% (53,7–64,2%). Если в качестве конечной точки использовался CIN2+, чувствительность (76% против 48%) и специфичность (71% против 94%) типирования ВПЧ в сочетании с TCT по сравнению с типированием ВПЧ в сочетании с TS показали, что AUC составляла 77,48% и 68,25% соответственно ( р = 0,086) (рис. 4 ).
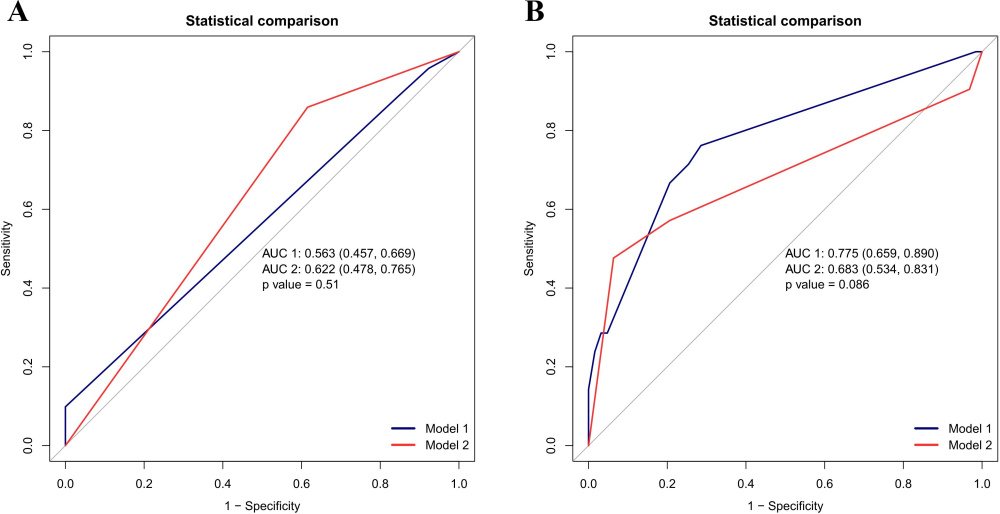
Рис. 4. Площадь под ROC-кривой цитологического теста ТhinРrep (TCT) и скрининга TruScreen (TS) для выявления рака шейки матки и предраковых заболеваний.
(A) Площадь под кривой (AUC) кривой TS составила 62,19% (62,2-76,54%), а TCT - 53,74% (53,7-64,2%). (B) При использовании цервикальной интраэпителиальной неоплазии (CIN) 2+ в качестве конечной точки, чувствительность (76% против 48%) и специфичность (71% против 94%). Типирование ВПЧ в сочетании с ТСТ по сравнению с ВПЧ в сочетании с TS продемонстрировали AUC 77,48% и 68,25%, соответственно(p = 0,086).
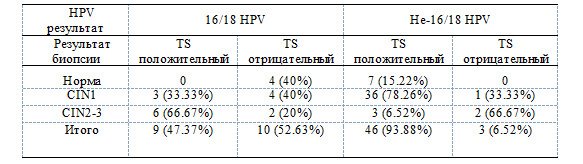
Среди 33 пациентов, чьи результаты TCT были ниже ASCUS и ВПЧ16/18 пололожительными, 19 прошли кольпоскопию, из которых 9 были TS-положительными и 10 - TS-отрицательными. Среди 9 положительных пациентов 3 имели CIN1 (33,33%) и 6 имели CIN2-3 (66,67%). Результаты биопсии были нормальными в 4 случаях (40%), в 4 случаях — CIN1 (40%) и в 2 случаях — CIN2-3 (20%) (табл. 2 ). Чувствительность и специфичность TS для диагностики поражений CIN3 и выше составила 67,7% и 80% соответственно.
Среди 251 пациентки ВПЧ 16/18 типа отрицательных пациентов с результатами TCT ниже, чем ASCUS, 85 были TS-положительными и 166 - отрицательными. Они были направлены на кольпоскопию в связи с TS-положительным тестом или персистирующей ВПЧ-инфекцией, но только 49 прошли кольпоскопию. Среди 46 пациентов, у которых результаты TCT были ниже, чем ASCUS, и по тесту на ВПЧ16/18 типа - отрицательные, но TS-положительных пациентов, у 7 из них было хроническое воспаление (15,22%, 7/46), у 36 - CIN1, 78,26% (36/46) , у 3 - CIN2-3, 6,52% (3/46). Среди 3 пациентов, у которых результаты TCT были меньше, чем по ASCUS, ВПЧ16/18 отрицательные и TS отрицательные, у 2 из них была CIN2-3, что составило 66,67% (2/3). Положительная прогностическая ценность TS для рака шейки матки и предраковых поражений составила 84,78%, чувствительность – 92,86% (табл . 2 ).
Таблица 2. Сравнение результатов биопсии и TS-теста у ТСТ-негативных пациентов высокого риска
4. Обсуждение
Большое количество эпидемиологических данных подтвердило, что тестирование на ВПЧ является точным методом первичного скрининга [ 7 ]. Недавний систематический обзор показал [ 8 ], что общий уровень заражения ВПЧ высокого риска в Китае составляет около 19%, причем наиболее распространенными являются 5 типов: 16, 52, 58, 53 и 18. Это согласуется с результатами, полученными в нашем исследовании. Однако ВПЧ-инфекция имеет определенную степень естественного клиренса, составляющую примерно 90% [9,10]. Это подтверждает идею о том, что направление всех инфицированных ВПЧ пациенток на кольпоскопию не является необходимым и приводит к огромной трате медицинских ресурсов.
Таким образом, более экономичным и разумным методом является выбор соответствующей схемы стратификации после того, как ВПЧ тест использовался для первичного скрининга. В настоящее время во многих исследованиях обсуждается возможность сортировки после TCT, но результаты TCT тесно связаны с опытом цитологов.
Целью данного исследования было изучение практической ценности TS в клинических условиях и возможности его использования в качестве стратегии выбора при скрининге рака шейки матки.
Это исследование показало, что у ВПЧ-положительных пациентов с патологическими результатом LSIL в качестве конечной точки чувствительность исследования TS была выше, чем у TCT, при этом специфичность ниже, чем у TCT. Чувствительность составила 85,92% и 16,90 % соответственно. Специфичность составила 38,46% и 92,31 % соответственно. Если в качестве конечной точки использовался CIN2+, чувствительность (76% против 48%) и специфичность (71% против 94%) типирование ВПЧ в сочетании с TCT по сравнению с TS в сочетании с AUC составила 77,48% против 68,25% ( р = 0,086).
У 251 пациента с ВПЧ высокого риска, не относящегося к 16/18 типу, с результатами TCT ниже, чем ASCUS, положительная прогностическая ценность TS рака шейки матки и предраковых поражений составила 84,78%, а чувствительность - 92,86%. Следовательно, TS можно рассматривать как один из инструментов стратифицированного ведения таких пациентов. Если TS положительный, пациенток с результатом TCT ниже ASCUS и не являющихся носителями ВПЧ16/18 высокого риска следует направить на кольпоскопическое обследование. Если TS отрицательный, можно рассмотреть возможность последующего наблюдения.
У ВПЧм16/18-позитивных пациентов с результатами TCT ниже, чем по ASCUS, значения TS у 2 пациентов (20%) были отрицательными, но при кольпоскопии был обнаружен CIN3. Таким образом, у пациентов с инфекцией HPV16/18 TS не рекомендуется в качестве инструмента стратифицированного отбора и рекомендуется направление на кольпоскопию. Предыдущие исследования показали, что TS имеет высокую точность выявления рака шейки матки и предраковых поражений [ 11 , 12 ] .
В систематическом обзоре 2018 года [ 13 ] характеристики комбинированного теста TS были следующими: чувствительность — 76%, специфичность — 69%, AUC — 0,7859 (Q = 0,7236). Стратегия сортировки скрининга TS для ВПЧ16/18 и 12 других типов ВПЧ высокого риска показала самую высокую чувствительность для CIN2+ (92,5%), но несколько меньшую специфичность (54,7%) [ 11 ]. Недавно опубликованное исследование показало, что у женщин врВПЧ, где CIN2+ использовался в качестве конечной точки исследования, специфичность теста ВПЧ в сочетании с TS была значительно выше, чем в сочетании с TCT (50% против 39,9%, p. = 0,004). Чувствительность теста на ВПЧ в сочетании с TS была сопоставима с чувствительностью теста на ВПЧ в сочетании с TCT (93,94% против 87,88%, p = 0,625) [14 ]. Другие исследования показали, что между двумя стратегиями нет существенной разницы в частоте выявления ВПЧ-положительного результата [15 ].
Существует множество факторов, которые могут повлиять на результаты исследования. Например: (1) Цитологическая экспертиза патологоанатомических отделений в разных больницах выполняется различно. (2) В клинической практике противопоказания к TS обследованию были определены не точно, например, в течение 3 месяцев после родов или после процедуры цервикальной конизации, что могло повлиять на результаты исследования при помощи TS. (3) Точность результатов исследования TS в определенной степени зависит от того, был ли соблюден алгоритм процедуры. В процессе исследования зонд должен контактировать с поверхностью шейки матки. Если выделения на поверхности шейки матки чрезмерные или имеются явления воспаления, сигналы стимуляции могут быть не получены, а это может привести к ложноотрицательным или ложноположительным результатам. (4) Если полное покрытие поверхности шейки матки не было достигнуто или имелись поражения цервикального канала и стенки влагалища, которое также может привести к возможным ложноотрицательным или ложноположительным результатам.
В целом многие результаты исследований свидетельствуют о том, что это перспективная технология благодаря высокой чувствительности и специфичности. Кроме того, TS имеет ряд других преимуществ: он может давать результаты в режиме реального времени во время амбулаторных посещений гинеколога, его легко использовать, процедура не инвазивна, а удовлетворенность пациентов высока. Хотя текущий размер исследовательской выборки был небольшим, это исследование может обеспечить некоторую основу для стратегии стратификации при скрининге рака шейки матки. Следующий план — провести более масштабное популяционное исследование ценности TS в реальных клинических условиях.
Выводы
Исследование TS можно рассматривать как один из стратифицированных ¬методов ведения пациентов, не инфицированных ВПЧ 16/18, со значением TCT менее ASCUS. Таким пациентам при положительном результате TS рекомендуется немедленное направление на кольпоскопию, чтобы снизить вероятность ошибочной диагностики CIN. При отрицательном результате TS рекомендуется пройти контрольное обследование через 1 год. Кроме того, в регионах, сложных для последующего наблюдения пациентов, можно рассматривать TS как один из методов скрининга рака шейки матки благодаря его работе в режиме реального времени и быстрому реагированию. Однако следует учитывать применимую популяцию и стандартизированные рабочие процедуры. Таким образом, при принятии клинических решений следует учитывать возраст пациентов, историю предыдущих скринингов и требований к фертильности. Также, по-прежнему необходим дальнейший анализ данных крупномасштабных клинических исследований.
Доступность данных и материалов
Данные, использованные и/или проанализированные в ходе текущего исследования, можно получить у соответствующего автора по обоснованному запросу.
Вклад автора
LML и JZ разработали исследование. LML -выполнила методологию и анализ. LML подготовил черновик публикации, а JZ внес свой вклад в критическую доработку публикации. Оба автора прочитали и одобрили финальный вариант статьи. Оба автора приняли достаточное участие в работе и согласились нести ответственность за все аспекты работы.
Этический аспект и согласие на участие
Все субъекты дали информированное согласие на включение до участия в исследовании. Исследование проведено в соответствии с Хельсинкской декларацией. Протокол одобрен Этическим комитетом Пекинской больницы Аньчжэнь (Anzhen 2021113X) .
Подтверждение
Мы хотели бы выразить благодарность всем тем, кто помогал нам во время исследования и написания этой статьи. Благодарим всех рецензентов за их мнения и предложения.
Финансирование
Это исследование проведено без внешнего финансирования.
Конфликт интересов
Авторы объявили об отсутствии конфликта интересов.
Ссылки
[1] Tsu V, Jeronimo J. Saving the World’s Women from Cervi¬cal Cancer. The New England Journal of Medicine. 2016; 374: 2509-2511.
[2] Di J, Rutherford S, Chu C. Review of the Cervical Cancer Bur-den and Population-Based Cervical Cancer Screening in China. Asian Pacific Journal of Cancer Prevention. 2015; 16: 7401-7407.
[3] Ghebreyesus TA. Global strategy to accelerate the elim¬ination of cervical cancer as a public health problem. 2020. Available at: https://www.who.int/publications/i/item/ 9789240014107 (Accessed: 17 November 2020).
[4] Canfell K, Chow C. Real-Time Devices for the Screening and Diagnosis of Cervical Neoplasia. Jordan JA, Singer A, Jones HW, Shafi MI (eds.). The Cervix (387-398). 2nd ed. Blackwell Publishing Ltd: Oxford, UK. 2006.
[5] de Sanjose S, Brotons M, Pavon MA. The natural history of hu¬man papillomavirus infection. Best Practice & Research. Clinical Obstetrics & Gynaecology. 2018; 47: 2-13.
[6] Wei L, Zhao Y, Shen D, Zhao F, Geng L, Bi H, et al. Expert Consensus on Cervical Cancer Screening and Abnormal Man-agement in China (I). Chinese Journal of Clinical Obstetrics and Gynecology. 2017; 2: 190-192. (In Chinese)
[7] Zhang J, Zhao Y, Dai Y, Dang L, Ma L, Yang C, et al. Effec-tiveness of High-risk Human Papillomavirus Testing for Cervi-cal Cancer Screening in China: A Multicenter, Open-label, Ran-domized Clinical Trial. JAMA Oncology. 2021; 7: 263-270.
[8] Li K, Li Q, Song L, Wang D, Yin R. The distribution and preva-lence of human papillomavirus in women in mainland China. Cancer. 2019; 125: 1030-1037.
[9] Smith RA, Andrews KS, Brooks D, Fedewa SA, Manassaram- Baptiste D, Saslow D, et al. Cancer screening in the United States, 2019: A review of current American Cancer Society guidelines and current issues in cancer screening. CA - a Cancer Journal for Clinicians. 2019; 69: 184-210.
[10] Schiffman M, Rodriguez AC. Heterogeneity in CIN3 diagnosis. The Lancet. Oncology. 2008; 9: 404-406.
[11] Chen F, Zhao Y, Li T, Chen W, Liu J, Wang J, et al. Clinical value of TruScreen in early diagnosis of cervical cancer and pre- cancerous lesions: a hospital-based multicenter study. Chinese Journal of Practical Gynecology and Obstetrics. 2021; 37: 348-352. (In Chinese)
[12] Rahmadhany R, Indarti J. A Real-time Optoelectronic Device in Screening of Precancerous Cervical Lesion. Indonesian Journal of Obstetrics and Gynecology. 2015; 3: 117-120.
[13] Yang H, Zhang X, Hao Z. The diagnostic accuracy of a real-time optoelectronic device in cervical cancer screening: A PRISMA-compliant systematic review and meta-analysis. Medicine. 2018; 97: e11439.
[14] Wei Y, Wang W, Cheng M, Hong Z, Gu L, Niu J, et al. Clinical evaluation of a real-time optoelectronic device in cervical can-cer screening. European Journal of Obstetrics, Gynecology, and Reproductive Biology. 2021; 266: 182-186.
[15] Ma Y, Di J, Bi H, Yang Q, Zhao Q, Qin T, et al. Analysis of the triage effect of TruScreen for human papillomavirus-positive women. Chinese Journal of Clinical Obstetrics and Gynecology. 2020; 21: 385-387. (In Chinese)
